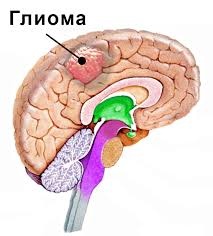
Новое международное исследование под руководством Кливлендской клиники идентифицировало новую лекарственную мишень для лечения глиобластомы. Эта мишень является частью ранее неизвестного клеточного пути, который способствует распространению и пролиферации опасной группы раковых клеток – глиомных стволовых клеток.
 Хотя предыдущие исследования показали, что белок FGF2 (фактор роста фибробластов 2), будучи активированным («включенным»), способствует самообновлению стволовых клеток глиомы и росту опухоли, было не понятно, как это происходит. Новое исследование идентифицировало FGF2 в качестве важного посредника в многоступенчатой прораковой сигнальной петле и показало, что «выключение» FGF2 может остановить рост и распространение глиобластомы.
Хотя предыдущие исследования показали, что белок FGF2 (фактор роста фибробластов 2), будучи активированным («включенным»), способствует самообновлению стволовых клеток глиомы и росту опухоли, было не понятно, как это происходит. Новое исследование идентифицировало FGF2 в качестве важного посредника в многоступенчатой прораковой сигнальной петле и показало, что «выключение» FGF2 может остановить рост и распространение глиобластомы.
Таким образом ученые впервые идентифицировали FGF2 в качестве новой лекарственной мишени для глиобластомы, самой распространенной первичной злокачественной опухоли головного мозга. При стандартном лечении медианная выживаемость для взрослых с глиобластомой составляет всего 11-15 месяцев, и часто возникает рецидив. Существует огромная потребность в новых методах лечения.
Внеклеточный матрикс представляет собой сеть молекул, которые, подобно кирпичу и строительному раствору, помогают удерживать и закреплять близлежащие клетки. Исследовательская группа обнаружила, что белок ADAMDEC1, который секретируется глиомными стволовыми клетками, расщепляет внеклеточный матрикс. Без матрикса раковые клетки получают доступ к основным питательным веществам для своего роста, которые иначе были бы недоступны.
Одним из этих питательных веществ является FGF2. Ученые продемонстрировали, что ADAMDEC1 активирует FGF2, который находится в микроокружении опухоли. Подобно замку и ключу, «включенный» FGF2 выборочно связывается и активирует рецептор, содержащийся на поверхности глиомных стволовых клеток (рецептор FGFR1).
FGFR1, опосредованный через несколько дополнительных сигнальных каскадов, играет две важные роли в управлении глиобластомой. Он помогает реализовать характерные для рака характеристики стволовых клеток глиомы, такие как способность к самообновлению и распространению. Кроме того, передача сигналов FGFR1 в конечном итоге индуцирует экспрессию ADAMDEC1, что вновь приводит в движение цикл клеточной обратной связи.
Идентифицированный путь показывает, что способность стволовых клеток глиомы получать доступ к основным питательным веществам при помощи ADAMDEC1 является неотъемлемой частью их распространения. Если найти способ прервать эту прораковую петлю, можно будет улучшить лечение глиобластомы и клинические исходы пациентов.
Источник: https://www.sciencedaily.com/releases/2019/08/190821100007.htm







Комментарии
Пока комментариев нет
Новый комментарий