 Исследование, опубликованное в журнале eLife, объясняет, как опухолевые клетки могут расти в условиях с низким содержанием кислорода, и раскрывает новую и уникальную лекарственную мишень, которая может быть использована для будущих методов лечения рака.
Исследование, опубликованное в журнале eLife, объясняет, как опухолевые клетки могут расти в условиях с низким содержанием кислорода, и раскрывает новую и уникальную лекарственную мишень, которая может быть использована для будущих методов лечения рака.
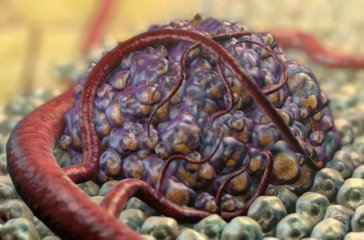
Гипоксия - недостаток кислорода в тканях организма - это известный признак рака. «Мы знаем, что гипоксические части опухолей содержат жировые капельки, и данные свидетельствуют о том, что способность опухоли накапливать эти капли связана с ее способностью выживать в условиях низкого кислорода», объясняет Сяодун Чжан, доктор философии, научный сотрудник Университет штата Аризона Мэйо, США, и ведущий автор исследования. «Но мы не понимали, как и почему образуются эти липидные капли, поэтому мы и начали это изучать».
Команда особенно заинтересована в роли молекулы фермента, называемой жировой триглицеридной липазой (ATGL), потому что она ускоряет распад жира и демонстрирует подавление роста опухоли. Но когда они разрушили ген ATGL в гипоксических раковых клетках, они не наблюдали дальнейшего накопления капель, что свидетельствовало об изменение активности ATGL, которое вызвало сокращение жира.
Чтобы узнать больше, они искали другие молекулы белка, которые могли бы участвовать в активности ATGL. Это привело их к молекуле под названием HIG2, которая обильно присутствует в широком спектре твердых опухолей, включая рак толстой кишки и почек. Они обнаружили, что HIG2 был совместно расположен с ATGL и имеет сходные свойства с другой молекулой, которая, блокирует ATGL. Они протестировали эффекты HIG2 на ATGL и обнаружили, что первая молекула специально блокирует разрушение жира, вызванное ATGL, и, как результат, увеличивает размер капель жира в клетках.
Затем команда захотела увидеть, были ли эти эффекты реплицированы в клетках с низким содержанием кислорода. Хотелось бы, чтобы HIG2 был резко активирован в условиях низкого кислорода и вызвал увеличение накопления жировых капель в клетках. Опять же, клетки с мутированным HIG2 не показали ни одного из этих эффектов. Однако, когда ATGL мутировал, накопление жира восстанавливалось. Это доказывает, что HIG2 работает для увеличения, хранения жира и снижения метаболизма в клетке путем специфической блокировки ATGL.
Итак, почему гипоксические раковые клетки пытаются блокировать распад жира? Следующие эксперименты команды показали, что в клетках без HIG2 условия с низким содержанием кислорода приводят к чрезмерному производству реактивных видов кислорода - увеличение почти на 250%. У мышей с опухолями удаление HIG2 вызвало глубокую задержку роста опухоли по сравнению с мышами с функционирующим HIG2.
«Мы нашли важный механизм выживания, который используют раковые клетки, когда находятся под низким уровнем кислорода», - заключает старший автор Джун Лью, профессор биохимии и молекулярной биологии в кампусе в Аризоне Клиники Майо. «Наши результаты оправдывают дальнейшее исследование взаимодействия HIG2-ATGL как основной терапевтической стратегии для лечения широкого спектра агрессивных видов рака».
Источник: https://medicalxpress.com/news/2017-12-cancer-cells-fat-metabolism-survival.html








Комментарии
Пока комментариев нет
Новый комментарий